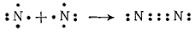Մարտի 6-10
Դասի թեման՝ Վալենտականություն:Տարրերի վալենտականության որոշումն ըստ քիմիական բանաձևի
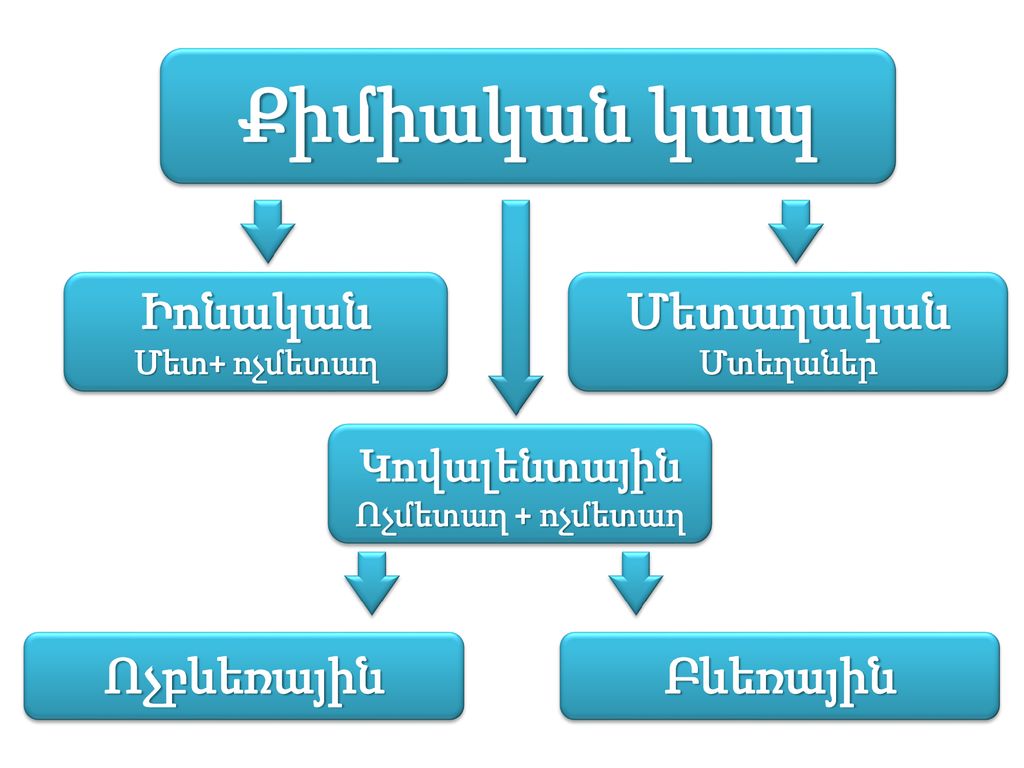
Վալենտականությունը քիմիական տարրի ատոմի՝ մի այլ տարրի խիստ որոշակի թվով ատոմներ միացնելու հատկությունն է:
Վալենտականությունն արտահայտվում է ամբողջ թվերով և գրվում է տարրի քիմիական նշանի վերևում` հռոմեական թվանշանով:
Օրինակ
Մեթանի մոլեկուլում տարրերի վալենտականությունը նշվում է հետևյալ կերպ.
CH4IIV
Քիմիական տարրերի վալենտականություն հասկացությունը պատկանում է (1852 թ.) անգլիացի նշանավոր քիմիկոս էդվարդ Ֆրանկլենդին:
Էդվարդ Ֆրանկլենդ
(1871-1937)
Ըստ նրա՝ քիմիական միացության մոլեկուլում տարրի վալենտականությունը հավասար է այդ տարրի առաջացրած կապերի թվին:
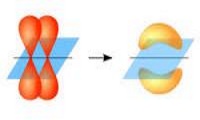
Նյութ առաջանալիս ատոմները կապվում են մեկը մյուսին արտաքին շերտի էլեկտրոնների փոխազդեցության հաշվին, և տարրի վալենտականությունը պայմանավորված է արտաքին էլեկտրոնների թվով, իսկ գլխավոր ենթախմբերի տարրերի արտաքին էլեկտրոնների թիվը հավասար է խմբի համարին:Քիմիական կապի առաջացմանը մասնակցող էլեկտրոններն անվանվում են վալենտային էլեկտրոններ:Ցանկացած տարրի առավելագույն վալենտականությունը հավասար է պարբերական համակարգում այդ տարրի խմբի համարին (բացառությամբ թթվածնի, ֆտորի և ազոտի):
Օրինակ՝ Քլորը և մանգանը գտնվում են VII խմբում և ցուցաբերում են VI -ի հավասար առավելագույն վալենտականություն.
Cl,VII MnVII
Ոչ մետաղները կարող են նաև դրսևորել վալենտականություն, որի թվային արժեքը ութի և խմբի համարի տարբերությունն է:
Օրինակ
Քլորն ունի նաև մեկի հավասար վալենտականություն (8−7=1), թթվածինը՝ երկուսի (8−6=2), ֆտորը՝ երեքի (8−5=3):
Վալենտականությունը կարող է լինել հաստատուն և փոփոխական: Այսպես, թթվածինը միշտ երկվալենտ է, ջրածինը և ֆտորը՝ միշտ միավալենտ, առաջին խմբի գլխավոր ենթախմբի տարրերը միայն միավալենտ են, երկրորդ խմբի գլխավոր ենթախմբինը՝ երկվալենտ: Ծծումբը ցուցաբերում է փոփոխական վալենտականություն՝ երկու, չորս, վեց,երկաթը՝ երկու, երեք, վեց և այլն:
Փոփոխական վալենտականությամբ տարրերի առաջացրած նյութերի անուններում տարրի անվանումից հետո փակագծերում հռոմեական թվանշանով գրվում է այդ տարրի վալենտականությունը:
Օրինակ
SO2-ի համար գրվում է ծծմբի (IV) օքսիդ և կարդացվում է «ծծմբի չորս օքսիդ», SO3 -ի համար գրվում է ծծմբի(VI) օքսիդ և կարդացվում է «ծծմբի վեց օքսիդ»:
Ժամանակակից տեսության համաձայն՝ ատոմի վալենտականությունը որոշվում է ատոմային օրբիտալներում չզույգված էլեկտրոնների թվով, որոնք ընդունակ են մասնակցելու այլ ատոմների հետ քիմիական կապի առաջացմանը: Ուստի հասկանալի է, որ վալենտականությունը միշտ արտահայտվում է ամբողջ թվերով:
Վալենտականություն հասկացությունն իմաստ ունի վերագրել միայն կովալենտային կապով առաջացած միացություններին: Իոնային կապով առաջացած միացությունների համար գործածվում է իոնի լիցք հասկացությունը:
Քիմիական տարրի ատոմի վալենտականությունը տարրի ատոմի առաջացրած կովալենտային կապերի թիվն է տվյալ միացության մոլեկուլում:
Կովալենտային կապերի քանակը, որն առաջացնում է քիմիական տարրի ատոմը տվյալ միացությունում, հավասար է ընդհանուր էլեկտրոնային զույգերի թվին:
Օրինակ
Ազոտի մոլեկուլում` N2(N≡N) ազոտի ատոմի (N) վալենտականությունը 3 է, իսկ թթվածնի մոլեկուլում՝ Օ2(O=O) թթվածնի ատոմի (O)՝2:
Իսկ ինչպե՞ս են որոշվում քիմիական տարրի վալենտականության հնարավոր արժեքները: Ընդունված է վալենտականության որոշման հետևյալ հասարակ կանոնը:
Երկտարր միացության քիմիական բանաձևում տվյալ տարրի բոլոր ատոմների վալենտային միավորների ընդհանուր թիվը հավասար է մյուս տարրի բոլոր ատոմների վալենտային միավորների ընդհանուր թվին:
Այս կանոնի հիման վրա, եթե հայտնի է մեկ տարրի վալենտականությունը, կարելի է որոշել մյուսինը՝ ըստ քիմիական բանաձևի:
Տարրի ատոմի վալենտականության որոշման համար ընդունելի է գործողությունների հետևյալ հաջորդականությունը:
1. Գրում ենք միացության բանաձևը և ատոմի վրա տեղադրում այն տարրի վալենտականությունը, որը հայտնի է (մեր օրինակում՝ թթվածնի և ջրածնի վալենտականությունները).
2. Գտնում ենք այդ տարրերի վալենտային միավորների ընդհանուր թիվը՝ տարրերի վալենտականության թվային արժեքը բազմապատկելով ինդեքսով.
3. Գտնում ենք մյուս տարրի վալենտականությունը՝ վալենտային միավորների ընդհանուր թիվը բաժանելով այդ տարրի ինդեքսին, և տեղադրում քիմիական նշանի վերևում.
Պատասխանել հարցերին
- Ի՞նչ եք հասկանում վալենտականություն ասելով:
Վալենտականությունը քիմիական տարրի ատոմի՝ մի այլ տարրի խիստ որոշակի թվով ատոմներ միացնելու հատկությունն է: - Միացությունում ո՞ր տարրի վալենտականությունը չի համապատասխանում խմբի համարին:
ա.F բ.S գ.O դ.Ne ե.Cl - Որոշե՛ք տարրերի վալենտականությունը հետևյալ բանաձևերում՝
CO2 SiO2 N2O3 N2O5 Cl2O